- 2014年03月24日
- 大鵬薬品工業株式会社
新規抗悪性腫瘍剤「ロンサーフ®配合錠」製造販売承認取得のお知らせ
大鵬薬品工業株式会社(本社:東京、代表取締役社長:小林 将之)は、抗悪性腫瘍剤「ロンサーフ®配合錠T15・T20」(一般名:トリフルリジン、チピラシル塩酸塩 開発コード:TAS-102、以下本剤)について、本日、「治癒切除不能な進行・再発の結腸・直腸癌 (標準的な治療が困難な場合に限る)」の効能・効果で、厚生労働省より製造販売承認を取得したことをお知らせします。
本剤の承認は全世界で日本が最初であり、国内第Ⅱ相臨床試験の成績等に基づいています。現在、進行再発結腸・直腸がん患者を対象とした国際共同臨床第Ⅲ相試験 (試験名:RECOURSE)を実施しています。
本剤は、トリフルリジン(FTD)とチピラシル塩酸塩(TPI)を配合した経口のヌクレオシド系抗悪性腫瘍剤です。FTDはDNAの複製時にチミジンの代わりに直接DNA鎖に取り込まれ、DNAの機能障害を引き起こして抗腫瘍効果を発揮すると推測されています。TPI はFTDの分解に関与するチミジンホスホリラーゼを阻害し、FTDの血中濃度を維持します。
大鵬薬品は、標準的な治療が困難で治癒切除不能な進行・再発の結腸・直腸癌に対し、本剤が新たな選択肢の一つとして、患者さんの治療に貢献できることを期待しています。
承認内容の概要について
| 製品名 | ロンサーフ®配合錠T15、ロンサーフ®配合錠T20 |
|---|---|
| 一般名 | トリフルリジン、チピラシル塩酸塩 |
| 効能・効果 | 治癒切除不能な進行・再発の結腸・直腸癌(標準的な治療が困難な場合に限る) |
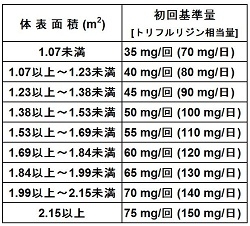
| 用法・用量 | 通常、成人には初回投与量(1回量)を体表面積に合わせて次の基準量とし(トリフルリジンとして約35 mg/m2/回)、朝食後及び夕食後の1日2回、5日間連続経口投与したのち2日間休薬する。これを2回繰り返したのち14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。 |
ニュースリリースに記載されている内容は、報道発表日現在の情報です。
当社のニュースリリースは、報道関係者への情報提供を目的としています。医療用医薬品や開発品に関する情報を含む場合がありますが、これらはプロモーション、広告、医療上のアドバイスを目的としたものではありません。
