非小細胞肺癌
非扁平上皮非小細胞肺癌の臨床試験 「警告・禁忌を含む注意事項等情報」等は最新の電子添文をご参照ください。
海外第Ⅲ相試験:IMpower130試験1)
Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial(IMpower130試験)
- 1)West, H. et al.: Lancet Oncol., 2019, 20(7), 924-937
West, H. et al.: Lancet Oncol., 2019, 20(7), 924-937 Supplementary appendix
試験概要
化学療法の治療歴がない、ステージⅣの非扁平上皮非小細胞肺癌患者の一次治療として、アブラキサン/カルボプラチン/アテゾリズマブ併用とアブラキサン/カルボプラチン併用の有効性と安全性を比較しました。
試験デザイン 多施設共同無作為化非盲検比較第Ⅲ相臨床試験
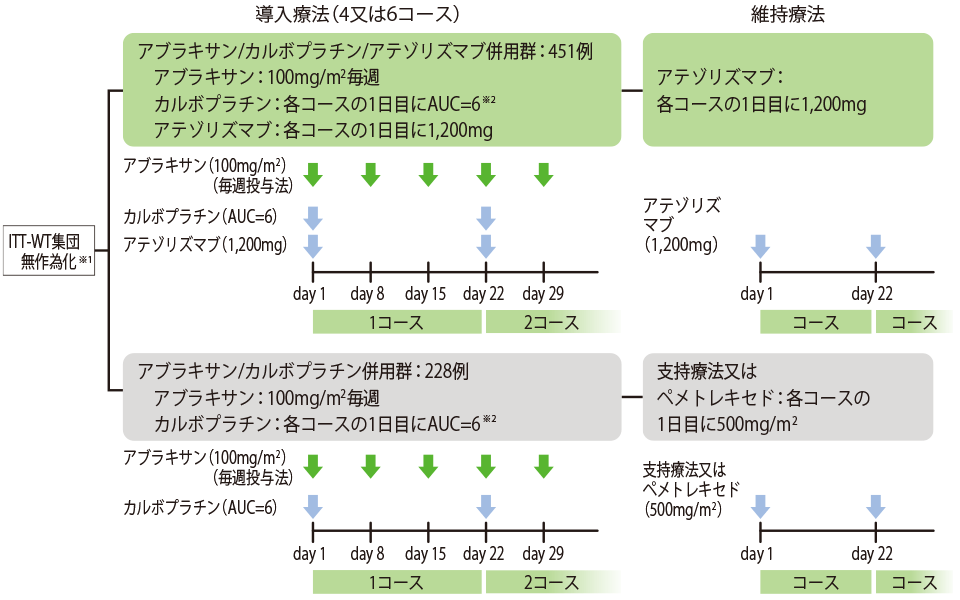
- ※1 割付調整因子:性別、ベースライン時の肝転移の有無、IHC法によるPD-L1発現状況[TC3かつIC問わず vs. TC0/1/2かつIC2/3 vs. TC0/1/2かつIC0/1]
- ※2 カルボプラチンの国内で承認されている非小細胞肺癌の用法及び用量は「通常、成人にはカルボプラチンとして、1日1回300~400mg/m2(体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。なお、投与量は、年齢、疾患、症状により適宜増減する。」である。
評価項目
- 主要評価項目:ITT-WT集団※1における無増悪生存期間(PFS)、全生存期間(OS)
- 副次評価項目:ITT集団におけるPFS、OS 等
- ※1 ITT-WT集団:EGFR遺伝子変異陽性患者又はALK融合遺伝子陽性患者以外のITT集団
評価基準
- PFS:RECIST v1.1に従う
- 安全性:NCI CTCAE v4.0に従う
解析方法
PFS、OSの群間差の検定には層別log-rank検定※1を用いました(両側有意水準:PFS 0.006、OS 0.0425)。また、PFS、OSのHR、95%信頼区間の推定には層別Cox回帰モデルを用いました。 PFSの解析はOSの中間解析時に実施することとし、中間解析はITT-WT集団で約352件のOSイベントが認められたときに実施することとしました。
- ※1 層別因子:性別、ベースライン時の肝転移の有無、IHC法によるPD-L1発現状況[TC3かつIC問わず vs. TC0/1/2かつIC2/3 vs. TC0/1/2かつIC0/1]
患者背景
症例の内訳
| アブラキサン/カルボプラチン/ アテゾリズマブ併用群 |
アブラキサン/カルボプラチン 併用群 |
|
|---|---|---|
| ITT集団 | 483 | 240 |
| ITT-WT集団 | 451 | 228 |
| 安全性評価対象例数 | 473 | 232 |
治療の実施状況
| アブラキサン/カルボプラチン/ アテゾリズマブ併用群 |
アブラキサン/カルボプラチン 併用群 |
|
|---|---|---|
| フォローアップ期間 中央値(月) [四分位範囲]* |
18.5[15.2–23.6] | 19.2[15.4–23.0] |
*ITT-WT集団
患者特性
症例数(%)
| 背景因子 | ITT集団 | ITT-WT集団 | |||
|---|---|---|---|---|---|
| アブラキサン/ カルボプラチン/ アテゾリズマブ併用群 (n=483) |
アブラキサン/ カルボプラチン併用群 (n=240) |
アブラキサン/ カルボプラチン/ アテゾリズマブ併用群 (n=451) |
アブラキサン/ カルボプラチン併用群 (n=228) |
||
| 年齢(歳) | 中央値[範囲] | 64[18–86] | 65[38–85] | 64[18–86] | 65[38–85] |
| <65歳 | 245(51) | 117(49) | 227(50) | 114(50) | |
| 65–74歳 | 186(39) | 90(38) | 174(39) | 84(37) | |
| 75–84歳 | 50(10) | 32(13) | 48(11) | 29(13) | |
| ≧85歳 | 2(<1) | 1(<1) | 2(<1) | 1(<1) | |
| 性別 | 女性 | 206(43) | 102(43) | 185(41) | 94(41) |
| 男性 | 277(57) | 138(58) | 266(59) | 134(59) | |
| 肝転移 | あり | 74(15) | 33(14) | 69(15) | 31(14) |
| なし | 409(85) | 207(86) | 382(85) | 197(86) | |
| 骨転移 | あり | 134(28) | 68(28) | 126(28) | 63(28) |
| 人種 | 白人 | 428(89) | 222(93) | 402(89) | 210(92) |
| 黒人又はアフリカ系アメリカ人 | 18(4) | 8(3) | 17(4) | 8(4) | |
| アジア人 | 14(3) | 3(1) | 12(3) | 3(1) | |
| 複数人種の混血 | 2(<1) | 0 | 1(<1) | 0 | |
| 不明 | 21(4) | 7(3) | 19(4) | 7(3) | |
| ECOG PS | 0 | 204(42) | 93(39) | 189(42) | 91(40) |
| 1 | 278(58) | 146(61) | 261(58) | 136(60) | |
| 2 | 0 | 1(<1) | 0 | 1(<1) | |
| 喫煙状況 | 喫煙歴なし | 64(13) | 20(8) | 48(11) | 17(7) |
| 現在喫煙中 | 96(20) | 53(22) | 92(20) | 51(22) | |
| 喫煙歴あり(禁煙) | 323(67) | 167(70) | 311(69) | 160(70) | |
| 病理/組織型 | 腺癌 | 462(96) | 230(96) | 432(96) | 218(96) |
| 神経内分泌の特性を有する腺癌 | 5(1) | 4(2) | 4(1) | 4(2) | |
| 腺扁平上皮癌 | 4(1) | 0 | 4(1) | 0 | |
| 細気管支肺胞上皮癌 | 1(<1) | 1(<1) | 1(<1) | 1(<1) | |
| 大細胞癌 | 6(1) | 2(1) | 6(1) | 2(1) | |
| 肉腫 | 2(<1) | 0 | 2(<1) | 0 | |
| 未分化 | 1(<1) | 2(1) | 1(<1) | 2(1) | |
| Not applicable | 1(<1) | 0 | 1(<1) | 0 | |
| 不明 | 1(<1) | 1(<1) | 0 | 1(<1) | |
| コース数 | 4 | 244(51) | 127(53) | 227(50) | 119(52) |
| 6 | 239(49) | 113(47) | 224(50) | 109(48) | |
| EGFR/ALK遺伝子異常 | あり | 32(7) | 12(5) | 0 | 0 |
| 腫瘍のPD-L1発現状況 | 高発現* | 91(19) | 43(18) | 88(20) | 42(18) |
| 低発現† | 139(29) | 68(28) | 128(28) | 65(29) | |
| 陰性‡ | 253(52) | 129(54) | 235(52) | 121(53) | |
- * TC3又はIC3:腫瘍細胞の≧50%又は腫瘍浸潤免疫細胞の≧10%でPD-L1が発現
- † TC1/2又はIC1/2:腫瘍細胞の≧1%、<50%又は腫瘍浸潤免疫細胞の≧1%、<10%でPD-L1が発現
- ‡ TC0かつIC0:腫瘍細胞の<1%かつ腫瘍浸潤免疫細胞の<1%でPD-L1が発現
Reprinted from The Lancet, 20. 7, West H, et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial, 924-937, Copyright (2019), with permission from Elsevier.
有効性
(2018年3月15日データカットオフ)
無増悪生存期間(ITT-WT集団):主要評価項目
ITT-WT集団を対象とした無増悪生存期間(PFS)中央値は、アブラキサン/カルボプラチン/アテゾリズマブ併用群で7.0ヵ月[95%信頼区間:6.2–7.3]、アブラキサン/カルボプラチン併用群で5.5ヵ月[95%信頼区間:4.4–5.9]でした。両側有意水準0.006でアブラキサン/カルボプラチン併用群に対するアブラキサン/カルボプラチン/アテゾリズマブ併用群の優越性が検証されました(層別HR=0.64、95%信頼区間:0.54-0.77、層別log-rank検定、p<0.0001)。
無増悪生存期間(Kaplan-Meier曲線)
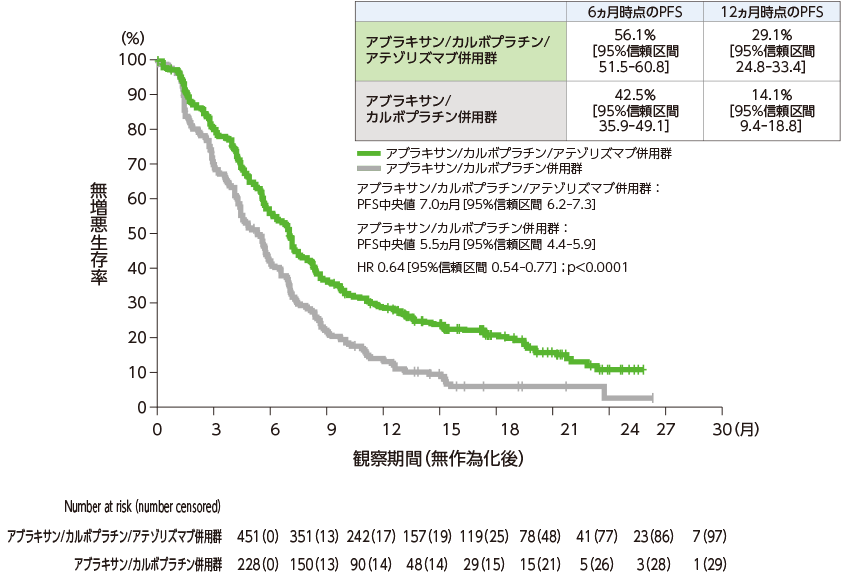
- p値:層別log-rank検定 両側有意水準:0.006 層別Cox回帰モデル
- 層別因子:性別、ベースライン時の肝転移の有無、IHC法によるPD-L1発現状況[TC3かつIC問わず vs. TC0/1/2かつIC2/3 vs. TC0/1/2かつIC0/1]
Reprinted from The Lancet, 20. 7, West H, et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial, 924-937, Copyright (2019), with permission from Elsevier.
全生存期間(ITT-WT集団、中間解析):主要評価項目
ITT-WT集団を対象とした全生存期間(OS)中央値は、アブラキサン/カルボプラチン/アテゾリズマブ併用群で18.6ヵ月[95%信頼区間:16.0–21.2]、アブラキサン/カルボプラチン併用群で13.9ヵ月[95%信頼区間:12.0–18.7]でした。両側有意水準0.0425でアブラキサン/カルボプラチン併用群に対するアブラキサン/カルボプラチン/アテゾリズマブ併用群の優越性が検証されました(層別HR=0.79、95%信頼区間:0.64–0.98、層別log-rank検定、p=0.033)。
全生存期間(Kaplan-Meier曲線)
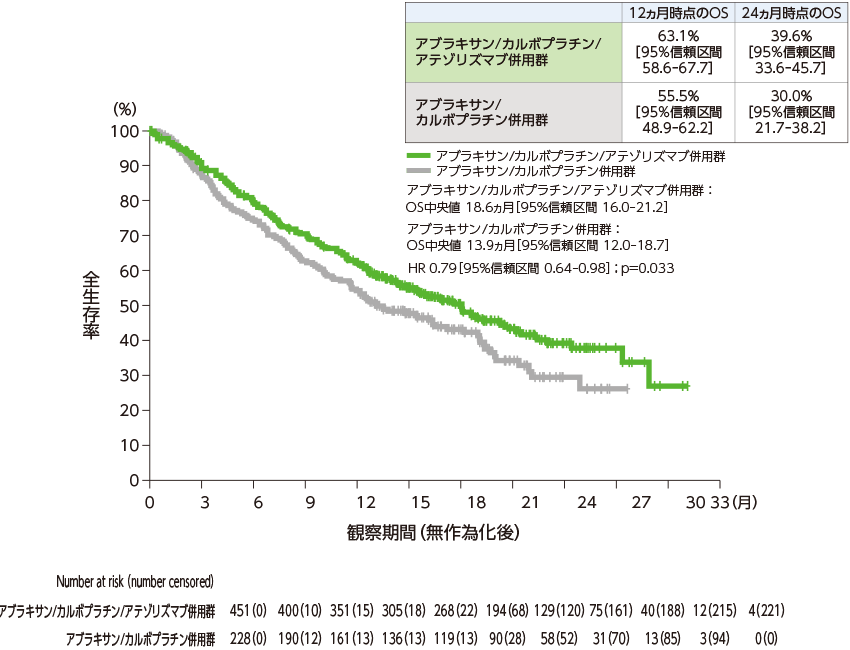
- p値:層別log-rank検定 両側有意水準:0.0425 層別Cox回帰モデル
- 層別因子:性別、ベースライン時の肝転移の有無、IHC法によるPD-L1発現状況[TC3かつIC問わず vs. TC0/1/2かつIC2/3 vs. TC0/1/2かつIC0/1]
Reprinted from The Lancet, 20. 7, West H, et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial, 924-937, Copyright (2019), with permission from Elsevier.
安全性
安全性解析対象集団(無作為化され、いずれかの治験薬の投与を受けた患者全例)における副作用の発現率は、アブラキサン/カルボプラチン/アテゾリズマブ併用群96%(455/473例)、アブラキサン/カルボプラチン併用群93%(215/232例)であり、いずれかの群で10%以上発現した副作用あるいはGrade 3-4で5%以上発現した副作用は以下のとおりでした。
いずれかの群で10%以上発現した副作用あるいはGrade 3-4で5%以上発現した副作用
症例数(%)
| アブラキサン/カルボプラチン/ アテゾリズマブ併用群 (n=473) |
アブラキサン/カルボプラチン併用群 (n=232) |
|||||||
|---|---|---|---|---|---|---|---|---|
| Grade 1 or 2 | Grade 3 | Grade 4 | Grade 5 | Grade 1-2 | Grade 3 | Grade 4 | Grade 5 | |
| 副作用 | 101(21) | 237(50) | 109(23) | 8(2) | 74(32) | 109(47) | 31(13) | 1(<1) |
| 好中球減少症* | 66(14) | 92(19) | 60(13) | 0 | 39(17) | 47(20) | 18(8) | 0 |
| 貧血 | 110(23) | 138(29) | 0 | 0 | 62(27) | 46(20) | 1(<1) | 0 |
| 好中球数減少* | 36(8) | 37(8) | 20(4) | 0 | 14(6) | 11(5) | 8(3) | 0 |
| 血小板減少症† | 82(17) | 30(6) | 15(3) | 0 | 43(19) | 12(5) | 3(1) | 0 |
| 血小板数減少† | 68(14) | 31(7) | 6(1) | 0 | 24(10) | 10(4) | 4(2) | 0 |
| 疲労 | 156(33) | 28(6) | 1(<1) | 0 | 77(33) | 14(6) | 0 | 0 |
| 白血球数減少 | 20(4) | 25(5) | 6(1) | 0 | 10(4) | 6(3) | 1(<1) | 0 |
| 下痢 | 127(27) | 22(5) | 1(<1) | 0 | 44(19) | 11(5) | 0 | 0 |
| 悪心 | 194(41) | 13(3) | 0 | 0 | 92(40) | 4(2) | 0 | 0 |
| 嘔吐 | 90(19) | 9(2) | 0 | 0 | 30(13) | 3(1) | 0 | 0 |
| 無力症 | 52(11) | 9(2) | 0 | 0 | 28(12) | 3(1) | 0 | 0 |
| 食欲減退 | 100(21) | 7(1) | 0 | 0 | 42(18) | 4(2) | 0 | 0 |
| 低マグネシウム血症 | 57(12) | 4(1) | 1(<1) | 0 | 21(9) | 3(1) | 0 | 0 |
| 便秘 | 72(15) | 1(<1) | 0 | 0 | 33(14) | 0 | 0 | 0 |
| 脱毛症 | 145(31) | 0 | 0 | 0 | 61(26) | 0 | 0 | 0 |
| 味覚異常 | 51(11) | 0 | 0 | 0 | 11(5) | 0 | 0 | 0 |
- NCI CTCAE v4.0に基づく評価
- * 好中球減少症と好中球数減少は医学的に同じ概念であるが、治験責任医師により異なる用語で報告された。
- † 血小板減少症と血小板数減少は医学的に同じ概念であるが、治験責任医師により異なる用語で報告された。
Reprinted from The Lancet, 20. 7, West H, et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial, 924-937, Copyright (2019), with permission from Elsevier.
重篤な副作用はアブラキサン/カルボプラチン/アテゾリズマブ併用群112例(23.7%)、アブラキサン/カルボプラチン併用群30例(12.9%)で発現し、主な事象(いずれかの群で発現率≧1%)は好中球減少症〔それぞれ3.0%(14例)、0.9%(2例)〕、貧血〔2.3%(11例)、2.6%(6例)〕、発熱性好中球減少症〔1.9%(9例)、2.2%(5例)〕、血小板減少症〔1.3%(6例)、0例〕、下痢〔2.5%(12例)、0.4%(1例)〕、悪心〔0.8%(4例)、1.3%(3例)〕、嘔吐〔0.6%(3例)、1.3%(3例)〕、肺炎〔1.1%(5例)、1.3%(3例)〕、発熱〔1.1%(5例)、0.4%(1例)〕、好中球数減少〔1.3%(6例)、0例〕、肺臓炎〔1.5%(7例)、0.4%(1例)〕でした。
有害事象による投与中止はアブラキサン/カルボプラチン/アテゾリズマブ併用群125例(26.4%)、アブラキサン/カルボプラチン併用群51例(22.0%)で発現し、主な事象(いずれかの群で発現率≧1%)は血小板減少症〔それぞれ3.6%(17例)、1.7%(4例)〕、好中球減少症〔3.0%(14例)、2.6%(6例)〕、貧血〔1.7%(8例)、0.9%(2例)〕、末梢性感覚ニューロパチー〔0.6%(3例)、1.7%(4例)〕、疲労〔1.5%(7例)、1.7%(4例)〕、肺炎〔1.3%(6例)、1.3%(3例)〕、呼吸困難〔1.3%(6例)、0例〕、好中球数減少〔1.7%(8例)、0.4%(1例)〕、血小板数減少〔1.7%(8例)、0.9%(2例)〕でした。
副作用による死亡はアブラキサン/カルボプラチン/アテゾリズマブ併用群で8例(肺臓炎2例、死亡、敗血症性ショック、心筋梗塞、心停止、心室性頻脈、肝硬変それぞれ1例)、アブラキサン/カルボプラチン併用群で1例(敗血症)認められました。


