非小細胞肺癌
扁平上皮非小細胞肺癌の臨床試験 「警告・禁忌を含む注意事項等情報」等は最新の電子添文をご参照ください。
国内第Ⅲ相試験:CAPITAL試験1)
Efficacy and safety of carboplatin with nab-paclitaxel versus docetaxel in older patients with squamous non-small-cell lung cancer (CAPITAL): a randomised, multicentre, open-label, phase 3 trial(CAPITAL試験)
- 1)Kogure Y, et al. Lancet Healthy Longev 2021; 2: e791–800.
本試験は大鵬薬品工業株式会社からの資金提供を受け実施されました。著者には大鵬薬品工業株式会社より研究費等を受領している者が含まれています。
試験概要
70歳以上の高齢者進行扁平上皮非小細胞肺癌の一次治療として、アブラキサン/カルボプラチン併用とドセタキセルの安全性と有効性を比較しました。
試験デザイン 多施設共同無作為化非盲検比較第Ⅲ相試験
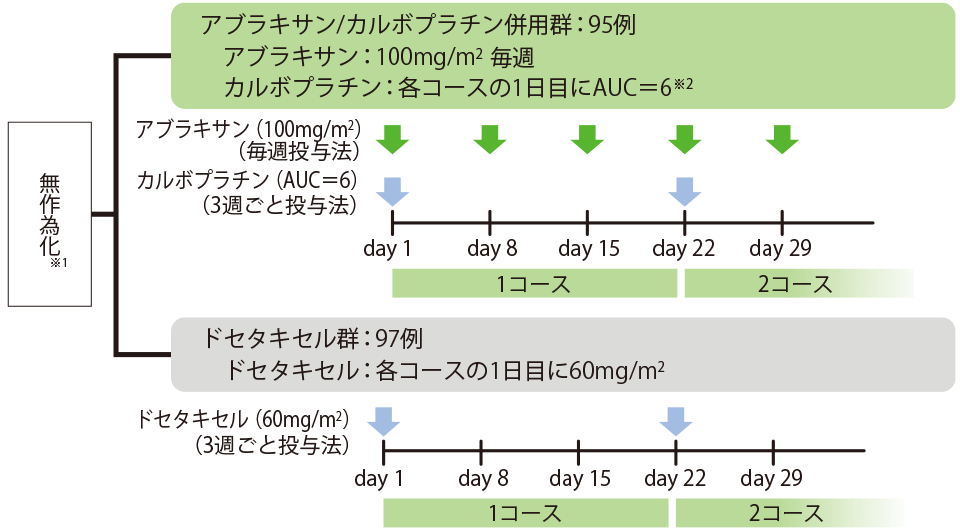
評価項目
- 主要評価項目:全生存期間(OS)
- 副次評価項目:無増悪生存期間(PFS)、全奏効率(ORR)、有害事象発現率、QOL
評価基準
- 治療効果判定:RECIST v1.1に従う
- QOL:FACT-L(Functional Assessment of Cancer Therapy-Lung)version 4 に従う
- 安全性:CTCAE v4.03に従う
解析方法
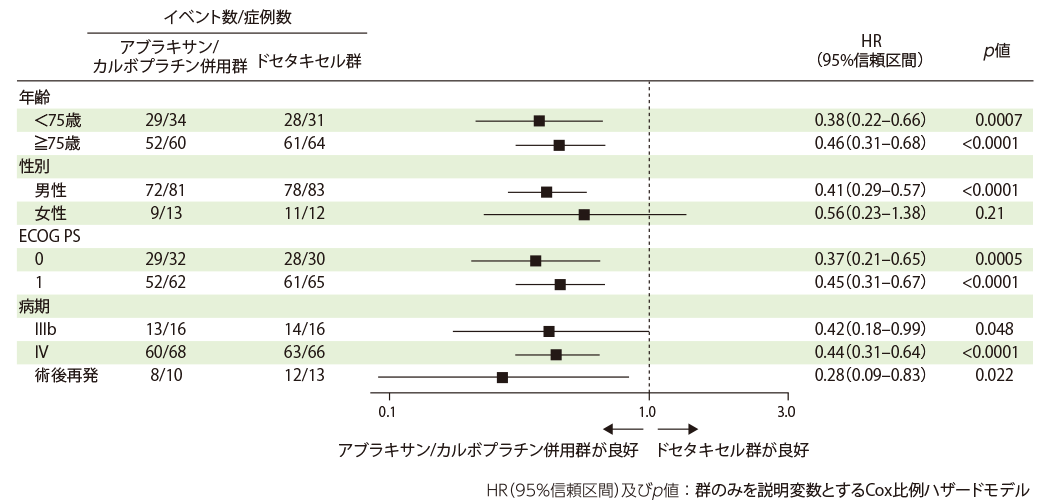
有効性の主要な解析にはFAS集団を用いました。OS、PFSの群間差の検定にはlog-rank検定を用いました。また、治療群間のハザード比(HR)とその95%信頼区間は年齢、性別、ECOG PS、病期を共変量に含めたCox比例ハザードモデルで求めました。
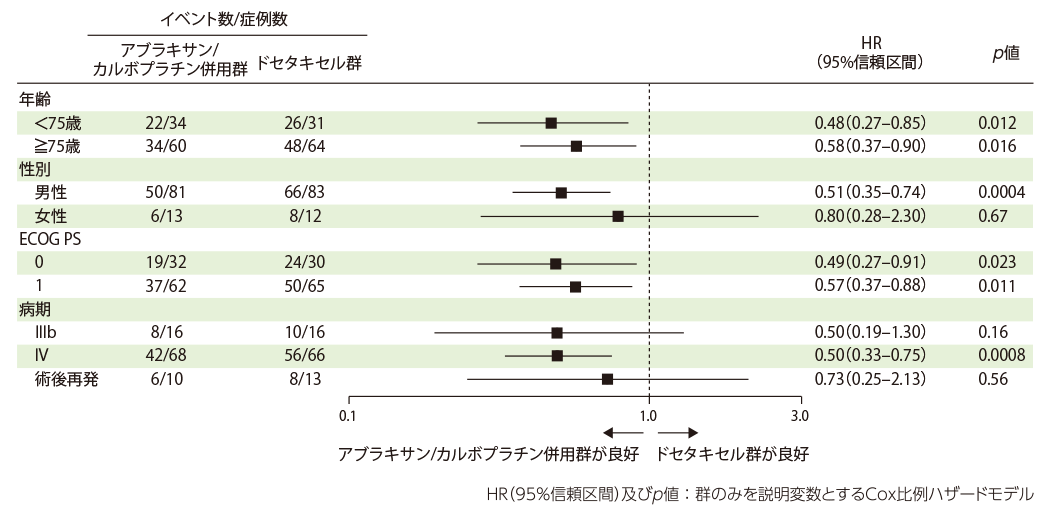
OS、PFSについて、事前に計画した項目(年齢、性別、ECOG PS、病期)でサブグループ解析を実施しました。
試験の途中に主たる目的が達成されたかどうかを判断する目的で、イベント数が98の時点のデータを用いて中間解析を実施することとしました(片側有意水準0.01058)。中間解析の方法はLan-DeMetsのα消費関数(O’Brien-Flemingタイプ)により多重性を調整しました〔片側有意水準=0.01058(p<0.001;log-rank検定)〕※3。
- ※1 割付調整因子:ECOG PS(0 vs. 1)、病期(ⅢB vs. Ⅳ vs. 再発)、性別(男性 vs. 女性)、年齢(<75歳 vs. ≧75歳)、施設
- ※2 カルボプラチンの投与コース上限を6コースとし、7コース目以降はアブラキサンのみを継続投与
- ※3 本試験は予定されていた中間解析において、主要評価項目(OS)が事前に規定された中止基準を満たしたため有効中止となった。
症例の内訳
| アブラキサン/カルボプラチン併用群 | ドセタキセル群 | |
|---|---|---|
| 登録例数 | 98 | 98 |
| 有効性評価対象例数 | ||
| FAS | 95 | 95 |
| PPS | 95 | 93 |
| 安全性評価対象例数 | 95 | 97 |
治療の実施状況
| アブラキサン/カルボプラチン併用群 | ドセタキセル群 | |
|---|---|---|
| フォローアップ期間 中央値(月) [四分位範囲] |
13.8[7.7-24.1] | 10.1[5.9–15.1] |
患者特性
| 背景因子 | アブラキサン/カルボプラチン併用群 (n=95) |
ドセタキセル群 (n=97) |
|
|---|---|---|---|
| 年齢中央値(歳) | 76(73〜78) | 77(73〜80) | |
| 範囲 | 70〜87歳 | 70〜88歳 | |
| <75歳 | 34(36) | 32(33) | |
| ≧75歳 | 61(64) | 65(67) | |
| 性別 | 男性 | 82(86) | 85(88) |
| 女性 | 13(14) | 12(12) | |
| ECOG PS | 0 | 33(35) | 31(32) |
| 1 | 62(65) | 66(68) | |
| 喫煙状況 | 喫煙歴なし | 6(6) | 3(3) |
| 現在喫煙中又は喫煙歴あり(禁煙) | 89(94) | 94(97) | |
| 病期 | ⅢB | 16(17) | 16(16) |
| Ⅳ | 68(72) | 68(70) | |
| 術後再発 | 11(12) | 13(13) | |
| ICI治療歴 | あり | 9(9) | 9(9) |
| なし | 86(91) | 88(91) | |
- データは中央値(IQR)、又は症例数(%)
- IQR:interquartile range(四分位範囲)
有効性
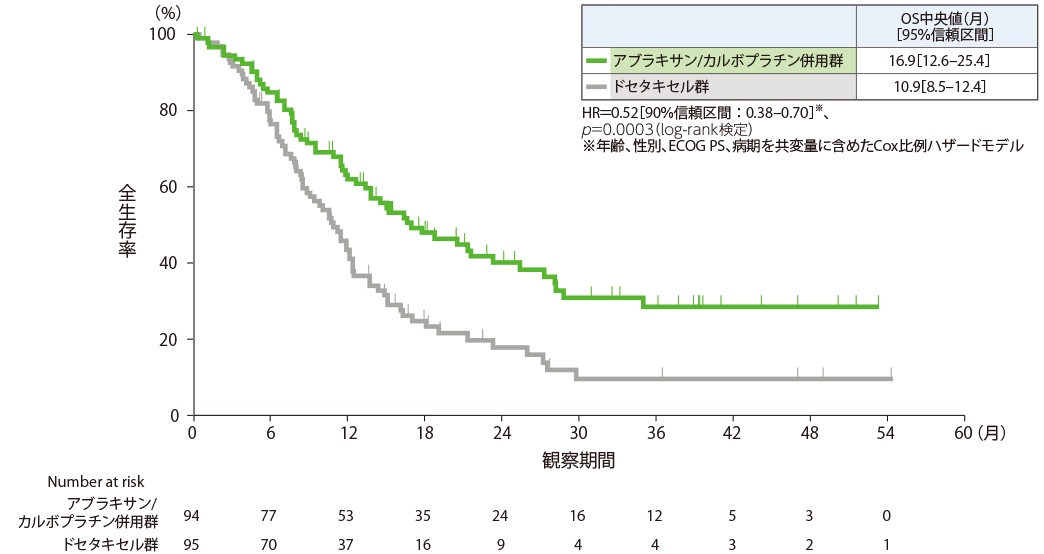
全生存期間(中間解析):主要評価項目
中間解析は2020年8月3日(イベント数:109)に実施しました。主要評価項目(OS)が事前に規定された中止基準を満たしたため、独立データモニタリング委員会より早期中止が推奨され、本試験は有効中止となりました。
最終解析の結果、全生存期間(OS)中央値は、アブラキサン/カルボプラチン併用群で16.9ヵ月[95%信頼区間:12.6‒25.4]、ドセタキセル群で10.9ヵ月[95%信頼区間:8.5‒12.4]であり、アブラキサン/カルボプラチン併用群で有意な延長が認められました(HR=0.52、90%信頼区間:0.38‒0.70、p=0.0003、log-rank検定[片側有意水準0.01058])。
全生存期間(Kaplan-Meier曲線)
全生存期間(主要評価項目のサブグループ解析)
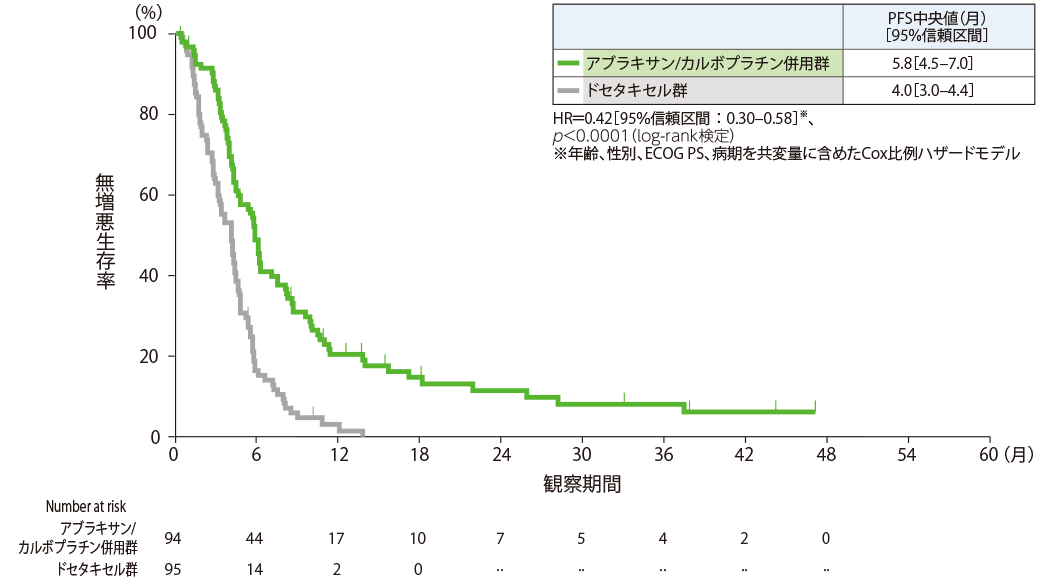
無増悪生存期間:副次評価項目
無増悪生存期間(PFS)中央値は、アブラキサン/カルボプラチン併用群で5.8ヵ月[95%信頼区間:4.5‒7.0]、ドセタキセル群で4.0ヵ月[95%信頼区間:3.0‒4.4]であり、アブラキサン/カルボプラチン併用群で有意な延長が認められました(HR=0.42、95%信頼区間:0.30‒0.58、p<0.0001、log-rank検定)。
無増悪生存期間(Kaplan-Meier曲線)
無増悪生存期間(副次評価項目のサブグループ解析)
全奏効率:副次評価項目
全奏効率(ORR)中央値は、アブラキサン/カルボプラチン併用群66%[95%信頼区間56ー76]、ドセタキセル群28%[95%信頼区間19ー38]であり、アブラキサン/カルボプラチン併用群で有意に高くなりました(p<0.0001、Fisherの正確確率検定)。
治療中止の最も多い理由は両群とも病勢進行でした。〔アブラキサン/カルボプラチン併用群40例(42%)、ドセタキセル群48例(49%)〕。
全奏効率
| アブラキサン/カルボプラチン併用群 (n=95) |
ドセタキセル群 (n=93) |
||
|---|---|---|---|
| 奏効例数(率[95%信頼区間]) | 61 (66%[56‒76]) | 26 (28%[19‒38]) | |
| 最良効果 | CR | 2(2) | 0 |
| PR | 59(64) | 26(28) | |
| SD | 22(24) | 42(45) | |
| PD | 6(7) | 21(23) | |
| 評価不能 | 3(3) | 4(4) | |
RECIST v1.1による評価
データは症例数(%[95%信頼区間])、又は症例数(%)
安全性
安全性解析対象集団(登録例のうち、1回でも試験薬を投与した患者)における有害事象の発現例数は、アブラキサン/カルボプラチン併用群99%(94/95例)、ドセタキセル群99%(96/97例)であり、主な有害事象の発現は以下のとおりでした。
主な有害事象
症例数(%)
| アブラキサン/カルボプラチン併用群 (n=95) |
ドセタキセル群 (n=97) |
|||||
|---|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | Grade 1-2 | Grade 3 | Grade 4 | |
| 全有害事象 | 15(15.8) | 52(54.7) | 27(28.4) | 19(19.6) | 33(34.0) | 44(45.4) |
| 白血球減少症 | 37(38.9) | 37(38.9) | 7(7.4) | 28(28.9) | 43(44.3) | 12(12.4) |
| 好中球減少症 | 20(21.1) | 34(35.8) | 26(27.4) | 11(11.3) | 31(32.0) | 44(45.4) |
| 貧血 | 51(53.7) | 36(37.9) | 1(1.1) | 75(77.3) | 2(2.1) | 0 |
| 血小板減少症 | 59(62.1) | 9(9.5) | 3(3.2) | 19(19.6) | 1(1.0) | 0 |
| 発熱性好中球減少症 | - | 7(7.4) | 2(2.1) | - | 19(19.6) | 0 |
| 疲労 | 60(63.2) | 12(12.6) | 0 | 56(57.7) | 3(3.1) | 0 |
| 筋肉痛 | 18(18.9) | 1(1.1) | 0 | 13(13.4) | 0 | 0 |
| 関節痛 | 20(21.1) | 2(2.1) | 0 | 7(7.2) | 1(1.0) | 0 |
| 浮腫 | 8(8.4) | 1(1.1) | 0 | 17(17.5) | 1(1.0) | 0 |
| 末梢性感覚ニューロパチー | 47(49.5) | 1(1.1) | 0 | 7(7.2) | 0 | 0 |
CTCAE v4.03に基づく評価
重篤な治療関連有害事象はアブラキサン/カルボプラチン併用群13例(14%)、ドセタキセル群11例(11%)で発現し、その内訳はアブラキサン/カルボプラチン併用群で肺感染、イレウス、呼吸不全 各2例、気胸、胆嚢炎、下痢、骨折、甲状腺機能低下症、倦怠感、内臓動脈虚血 各1例、ドセタキセル群で脱水、発熱性好中球減少症、胃穿孔、胃潰瘍、白質脳症、肺臓炎、気胸、敗血症、肺感染、その他の肺障害、好中球減少症 各1例でした。
治療関連死は、アブラキサン/カルボプラチン併用群で2例(呼吸不全、内臓動脈虚血 各1例)、ドセタキセル群で1例(敗血症)認められました。
- ※ 投与中止に至った有害事象の発現例数・事象名は論文中に記載なし。DIの安全性情報を参照のこと。


