次世代の創薬を見据え、
独自に培った基盤技術の
進化と発展を

次世代の創薬を見据え、
独自に培った基盤技術の
進化と発展を
大鵬薬品は患者さんのかけがえのない「いつもを、いつまでも。」を実現するために、ものづくり基盤の構築に注力してきました。経口抗がん剤として代謝拮抗剤の創薬から始まり多種多様なパイプラインを創製し、多数の品目が臨床開発段階に進んでいます。がん領域における創薬基盤の変遷と現在の進化をご紹介します。
大鵬薬品の
創薬研究
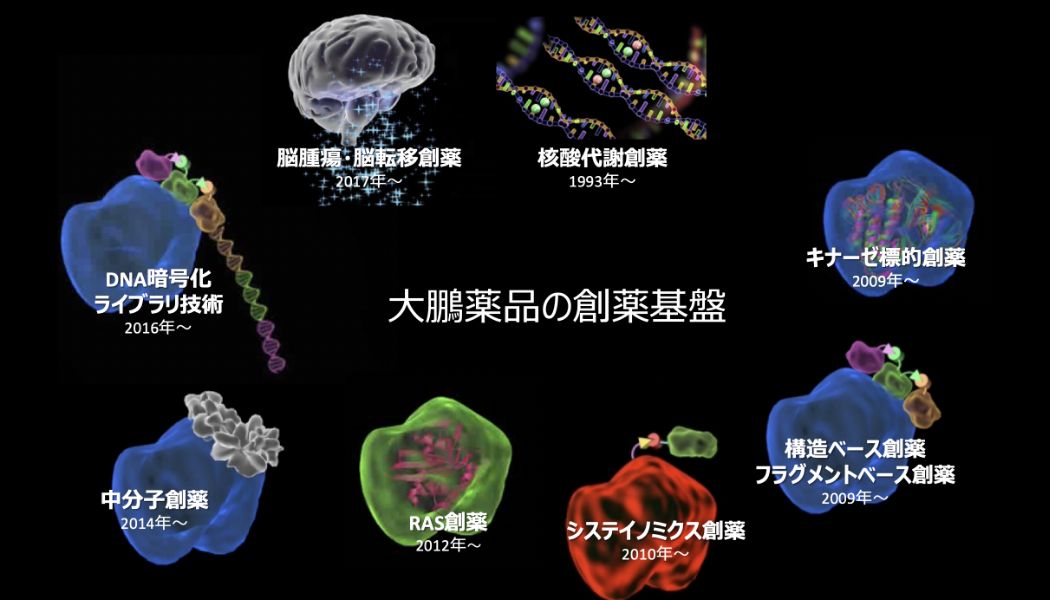
創薬基盤の変遷
オープン
イノベーション

1969年に私たちはがん領域での研究開発を本格的に開始し、がん細胞中にある核酸の合成に必要な物質の形成を阻害し、がん細胞の増殖を抑える代謝拮抗剤の創薬技術を強みに複数の新薬を国内で上市しました。2014年に大腸がんの治療薬として国内で発売した「ロンサーフ®」は、世界中の国・地域で承認されています。
長年にわたり、代謝拮抗剤で培ったノウハウを元に、創薬研究はがん細胞が増殖する際のシグナル伝達に必要なキナーゼ(リン酸化酵素)を阻害するキナーゼ創薬へと進み、2010年代に入ってフラグメント(低分子化合物)創薬の基盤を整えました。2012年からは、変異型KRAS阻害薬創製に取り組んできました。RAS創薬は新薬創製が難しい標的といわれていますが、独自の創薬基盤技術を応用することで進展しました。(RASについては後述)
この独自の創薬基盤技術が、大鵬薬品の創薬の主軸になるシステイノミクス創薬です。この技術から創製されたFGFR阻害剤は、2022年に米国、2023年に日本で承認を取得しました。
システイノミクス創薬は新規標的に対してパイプライン創製を推進するとともに、化合物ライブラリーの拡充など技術の深化にも注力しており、AIとロボティクスを活用したデータ駆動型創薬へ加速的に発展しています。また新たなモダリティへの挑戦の1つとして2020年にペプチドリーム社独自のPeptide Discovery Platform System(PDPS)技術について同社と提携しました。長年蓄積した天然物由来のライブラリーに加え、中分子創薬への展開を進めています。それぞれのメリットを生かした戦略的な創薬の取り組みが動き始めています。
キナーゼ創薬とは:タンパク質のリン酸化を担う酵素をキナーゼといい、キナーゼの異常によって細胞の恒常性が失われ、がん細胞が増殖する一因になると言われている。キナーゼ創薬はこうした分子を標的とする阻害剤で細胞の増殖や転移を抑える。
フラグメント創薬とは:低分子生物活性物質の開発手法。フラグメントと呼ばれる分子量300未満の小さな分子のスクリーニングによって標的タンパク質と効率よく結合する分子を探索する。
RASとは細胞の増殖などに関わるタンパク質で、KRAS、NRAS、HRASの3種類があります。3種類の遺伝子のどれか一つに変異が起こると、異常のあるRASタンパク質が作られ、細胞が増殖し続けて、がんが発生しやすくなると考えられています。中でもKRASはヒトのがんにおいて最も高い頻度で変異が見られるがん遺伝子の一つです。がんの中でも特に死亡率の高い膵がん、大腸がん、肺がんなどにおいて、KRAS遺伝子の変異が多く検出されることが知られています。RAS遺伝子の変異が、がんのドライバー変異であることが発見されてから30年以上経過しますが、創薬が極めて難しい標的です。大鵬薬品は独自のシステイノミクス技術を応用することにより、KRAS遺伝子を標的とする創薬への道を切り拓きました。2012年から取り組んできたKRAS G12Cを標的としたシステイノミクス創薬により共有結合型阻害化合物を創製することに成功しています。
大鵬薬品は、2019年12月に大塚製薬子会社のアステックス社およびMerck & Co., Inc., Kenilworth,N.J., U.S.A.(MSD)社と、KRASがん遺伝子を含む複数の薬剤ターゲットに対して開発中の低分子阻害剤に特化したグローバルな研究提携とライセンスに関する独占的契約を締結しました。2021年に行った戦略的提携により、SHP2など他のKRASに関する標的にも拡大し、パートナーシップの下、良い薬剤を世の中に出すことを推進しています。
大鵬薬品の
創薬研究
創薬基盤の変遷
オープン
イノベーション